ОПУХОЛИ ГОЛОВНОГО МОЗГА НА КТ, МРТ И ПЭТ
1. Компьютерная томография (КТ)
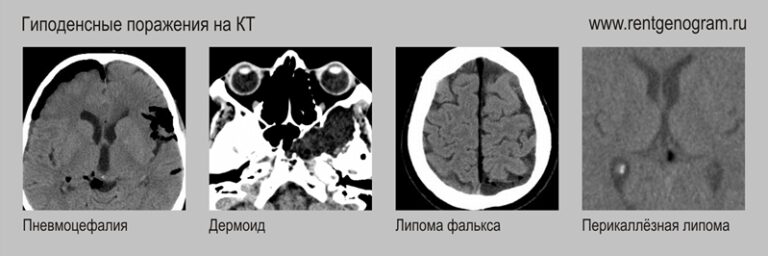
КТ предпочтительнее для выявления внутримозговых обызвествлений. Опухоли, склонные к кальцификации: олигодендроглиомы (90%), менингиомы, краниофарингиома, тератома, хордома, опухоли сосудистой оболочки, эпендимома и центральная нейроцитома. КТ предпочтительнее (по сравнению с МРТ) для оценки костей и внутриопухолевых кровоизлияний.
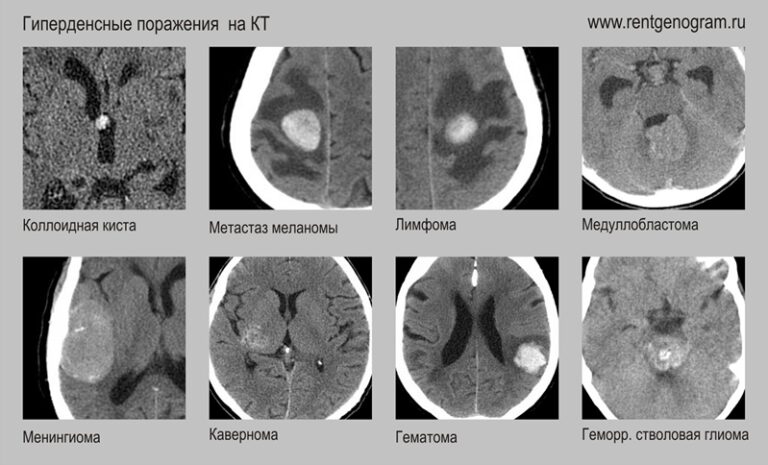
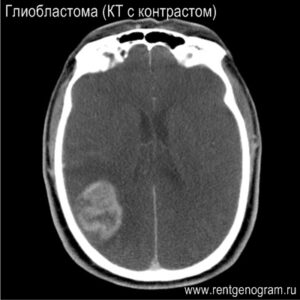
Поражения, гиперденсные на КТ:
- Лимфома
- Менингиома
- Метастаз меланомы
- Коллоидная киста
- Медуллобластома
- Кровоизлияние (в том числе в опухоль)
- Глиобластома с геморрагиями
- Кавернозная ангиома
- Эпендимома
- Липома
- Тератома
- Газ (воздух)
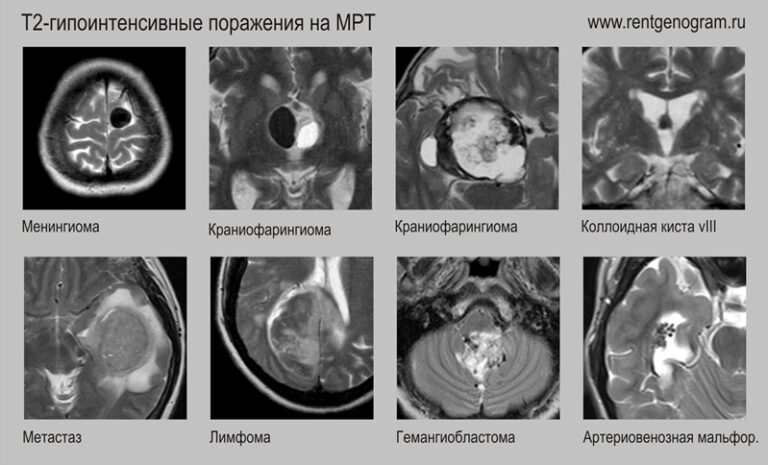
2. Магнитно-резонансная томография (МРТ)
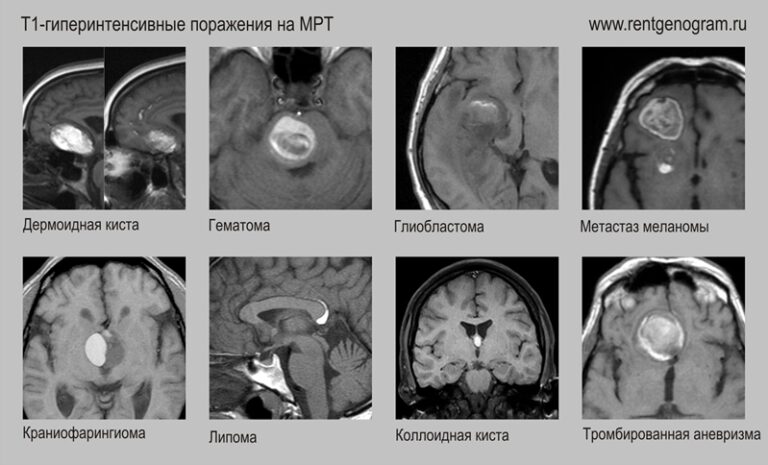
Поражения гиперинтенсинвные на Т1:
- Кровоизлияние (в том числе в опухоль)
- Глиобластома с геморрагиями
- Дермоидная киста
- Метастаз меланомы
- Краниофарингиома
- Коллоидная киста
- Липома
- Метгемоглобин в образованиях (в тромбированных аневризмах)
- Петрифицированная менингиома
- Коллоидная киста
- Краниофарингиома
- Гемангиобластома (сосуды в опухоли)
- Кавернома
- Метастазы колоректального рака
- Геморрагия в острую фазу (в том числе в опухоль)
- Гиперклеточные опухоли (лимфома, глиобластома, ПНЭО)
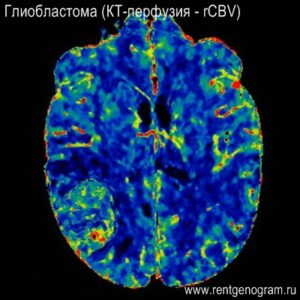
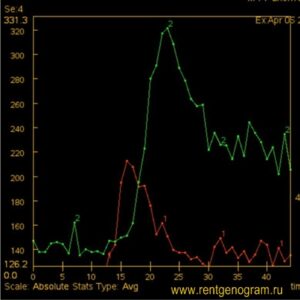
3. Перфузия
- заметно повышенный rCBV говорит о избыточной васкуляризации (рост опухолей высокой степени злокачественности);
- относительно повышенный rCBV — опухоли средней степени злокачественности;
- снижение rCBV (ниже значений нормального мозгового вещества противоположной стороны) — вазогенный отек, ишемия или радиационный некроз.
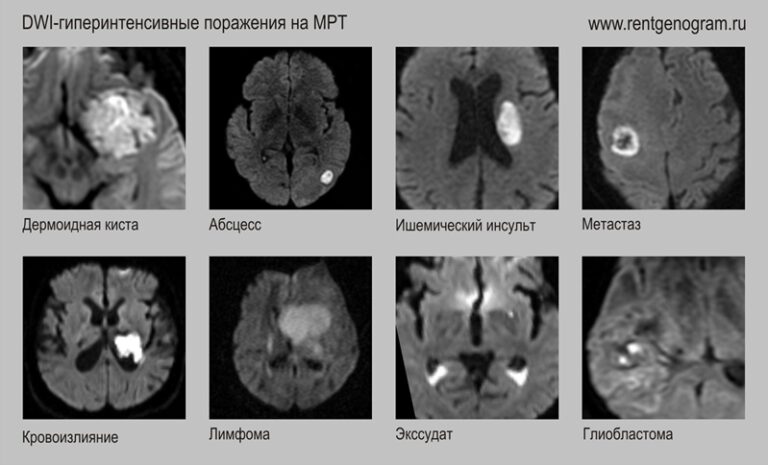
4. Диффузионная МРТ (ДВИ)
DWI и ADC отражают характер диффузии воды в тканях. Низкие значения ADC в опухоли, вероятно, отражают снижение объема внеклеточного пространства с увеличением плотности клеток опухоли и внутриклеточной вязкости с последующим ограничением движения воды.
Ограничение диффузии – высокий сигнал на DWI и низкий на ADC.
Отсутствие ограничения диффузии – низкий сигнал на DWI и высокий на ADC.
- Ишемический инсульт
- Абсцесс (септический или гнойный, не характерно для абсцесса, вызванного простейшими как при токсоплазмозе)
- Плотноклеточная опухолевая строма с низким ядерно-цитоплазмотическим отношением (характерно для злокачественной опухоли, например глиобластомы и медуллобластомы)
- Дермоид
- Подострая гематома
- Экссудат (эмпиема, вентрикулит)
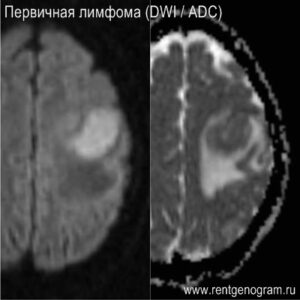
- Лимфома
- Некоторые метастазы (малохарактерно)
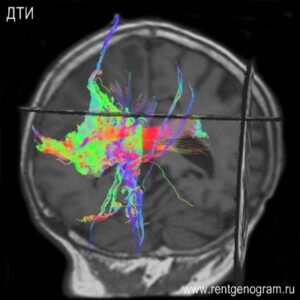
5. Диффузионно-тензорная МРТ (ДТИ)
ДТИ (трактография) показывает тракты в перитуморальной области, что помогает в дифференциальной диагностике первичной злокачественной мозговой опухоли (например, глиобластомы), которая приводит к деструкции траков в области роста и вторичной (метастатической) опухоли, которая дислоцирует тракты, а так же позволяет планировать безопасную резекцию опухоли.
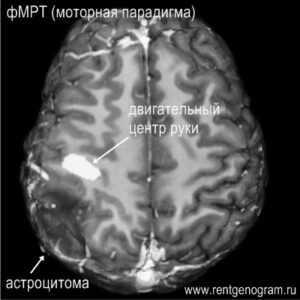
6. Функциональная МРТ (фМРТ)
фМРТ- дооперационная оценка речевой коры и проекционных нервных центров. Альтернатива фМРТ — интраоперационное электрическое картирование коры.
7. МР-спектроскопия (МРС)
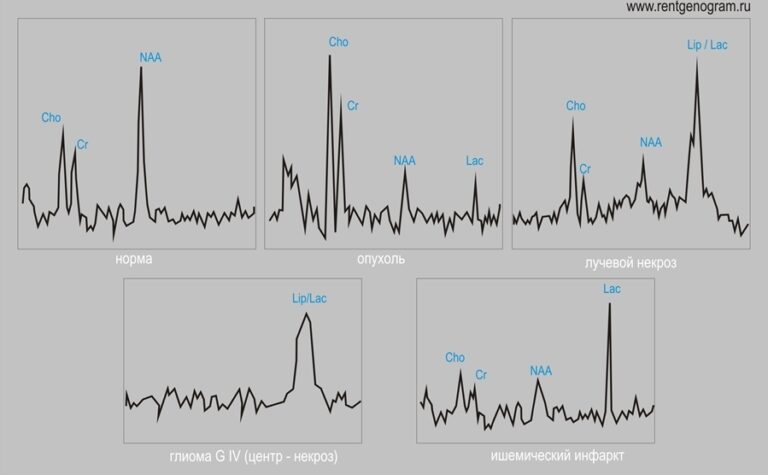
Опухоль:
- много мембран (холин ↑),
- нет нормальных нейронов (NAA ↓),
- анаэробный метаболизм (лактат ↑ и креатин ↓).
- повышенный — липид / лактат (большой пик)
- снизился — холин, NAA, креатин.
- нет нормальных нейронов (NAA ↓),
- нет нормальных мембран (холин ↓),
- нет никакого метаболизма (креатин ↓, лактат ↓)
- лактат ↑
- NАА ↓,
- креатин ↓,
- холин ↓ *
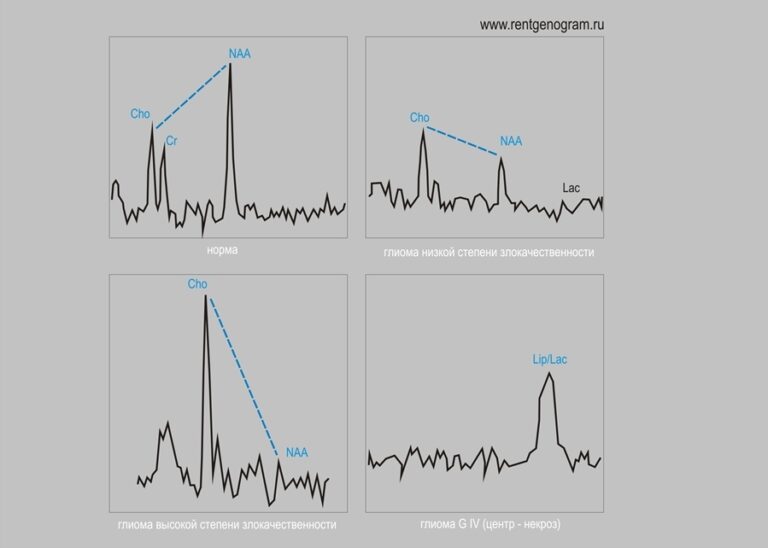
Некроз отражается в увеличении Lac/Lip комплекса, связанного с падением всех других метаболитов [5]. Самые высокие соотношения Cho/Cr и Cho/NAA наблюдаются при агрессивных опухолях и диффузных глиомах ствола мозга.
Повышенный уровень холина (Cho), заметно сниженный уровень креатина (Cr) и N-ацетил аспартата (NAA), существенно увеличенные отношения Cho/Cr (более 2,4) и Cho / NAA (более 10) с обратным углом Хантера (синяя линия на рис.13) свидетельствует о глиоме высокой степени злокачественности.
Нормальный спектр метаболитов, полученный из контралатеральной нормальной паренхимы головного мозга с нормальным углом Хантера (синяя линия на рис.13).
8. Особенности МР-спектроскопии у опухолей головного мозга детей
- Доброкачественная пилоцитарная астроцитома имеет высокий уровень Lac в результате все еще плохо изученного биохимического метаболизма.
- Соотношения Cho/NAA и Cho/Cr повышаются, несмотря на то, что эти поражения являются доброкачественными [2,4, 16].
- У детей повышенный уровень холина не является синонимом злокачественной опухоли.
- При нейрофиброматозе 1 типа соотношение Cho/Cr помогает различать локальное внутрипаренхиматозное поражение, которое является гиперинтенсивным при визуализации T2, от глиальных опухолей и здоровой паренхимы [15] у детей.
- Показано, что уровни миоинозитола повышаются при папилломе хориоидального сплетения [2, 15]. Это доброкачественное поражение, особенно по сравнению со злокачественной карциномы сосудистого сплетения, при котором повышается Cho [1]. Миоинозитол также повышен в эпендимоме [16].
- Концентрации таурина увеличиваются в ПНЭО [1, 10], а Ci (цитрин) обнаруживается в злокачественных инфильтративных астроцитомах моста [16].
- В опухолях герминативных клеток высокий уровень глютамин-глутамата.
9. Позитронно-эмиссионная томография (ПЭТ)
- характеристикой быстрорастущей опухоли является повышенный анаэробный гликолиз (ПЭТ с ФДГ демонстрирует высокую утилизацию глюкозы, но низкую экстракцию кислорода);
- метаболическая активность опухоли коррелирует с биологической агрессивностью – глиомы высокой степени злокачественности более гликолитически активны, чем глиомы низкой степени злокачественности;
- опухоли, которые реагируют на терапию, становятся гипометаболическими (до того, как они уменьшатся в размерах при МРТ);
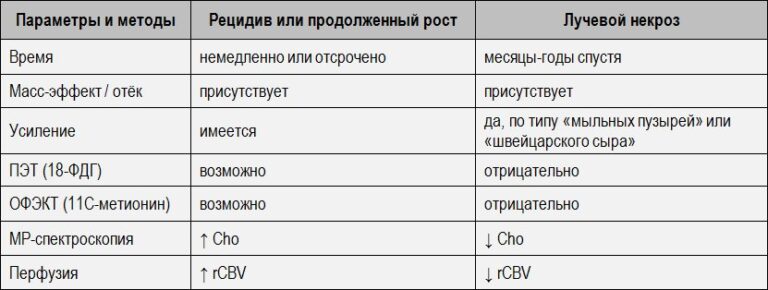
- рецидивирующая или остаточная ткань опухоли (↑гликолитическая активность);
- радиационный некроз (гликолитическая активность ↓) — часто выглядят одинаково с опухолью на МРТ и КТ (контрастное усиление, масс-эффект, отек);
- ложноположительные результаты: воспалительные клетки в зонах радиационного некроза могут проявлять повышенную метаболическую активность, при этом опухолевые клетки также могут присутствовать в областях с низким метаболизмом глюкозы.
10. Автор
Автор статьи: врач-рентгенолог к.м.н. Власов Евгений Александрович.
Допускается использование содержания статьи и распространение её полностью и частично при наличии гиперссылки на источник (данную интернет-страницу).
Дата публикации 7.04.2024г.
11. Скачать МРТ и КТ исследования в DICOM формате
Скачать МРТ и КТ исследования головного мозга, пораженного опухолью в DICOM-формате здесь.
12. Литература
- Kovanlikaya, A. Panigrahy, M.D. Krieger, I. Gonzalez-Gomez, N. Ghugre, J.G. McComb, et al.Untreated pediatric primitive neuroectodermal tumor in vivo: quantitation of taurine with MR spectroscopy Radiology, 236 (3) (2005), pp. 1020-1025
- Panigrahy, M.D. Krieger, I. Gonzalez-Gomez, X. Liu, J.G. McComb, J.L. Finlay, et al.Quantitative short echo-time 1H-MR spectroscopy of untreated pediatric brain tumors: preoperative diagnosis and characterization AJNR Am J Neuroradiol, 27 (3) (2006), pp. 560-572
- A.A. Tzika, S. Vajapeyam, P.D. BarnesMultivoxel proton MR spectroscopy and hemodynamic MR imaging of childhood brain tumors: preliminary observation AJNR Am J Neuroradiol, 18 (2) (1997), pp. 203-218
- X. Combaz, N. Girard, D. Scavarda, F. Chapon, S. Pineau, O. Levrier, et al.Imaging of brain tumors in children J Neuroradiol, 35 (5) (2008), pp. 261-267
- Anderson DR, Falcone S, Bruce JH, Mejidas AA, Post MJD. Radiologic-pathologic correlation. Congenital chororid plexus papillomas. AJNR Am J
- Brandao LA (2004) Inroduction and Technique. In: Bandao LA (ed) MR Spectroscopy of the Brain. Lippincott Williams & Wilkins, Philadelphia, pp 1–15
- Castillo M, Kwock L (1998) Proton MR spectroscopy of common brain tumors. Neuroimaging Clin N Am 8:733–752
- H.R. Arvinda, C. Kesavadas, P.S. Sarma, B. Thomas, V.V. Radhakrishnan, A.K. Gupta, et al.Glioma grading: sensitivity, specificity, positive and negative predictive values of diffusion and perfusion imaging J Neurooncol, 94 (1) (2009), pp. 87-96
- Z. Rumboldt, D.L. Camacho, D. Lake, C.T. Welsh, M. CastilloApparent diffusion coefficients for differentiation of cerebellar tumors in children AJNR Am J Neuroradiol, 27 (6) (2006), pp. 1362-1369
- J.F. Schneider, S. Confort-Gouny, A. Viola, Y. Le Fur, P. Viout, M. Bennathan, et al.Multiparametric differentiation of posterior fossa tumors in children using diffusion-weighted imaging and short echo-time 1H-MR spectroscopy J Magn Reson Imaging, 26 (6) (2007), pp. 1390-1398 CrossRefView Record in ScopusGoogle Scholar
- J.L. Jaremko, L.B. Jans, L.T. Coleman, M.R. DitchfieldValue and limitations of diffusion-weighted imaging in grading and diagnosis of pediatric posterior fossa tumors AJNR Am J Neuroradiol, 31 (9) (2010), pp. 1613-1616
- The 2007 WHO Classification of Tumours of the Central Nervous System [Acta Neuropathol (2007) 114:97–109]
- L. Porto, A. Jurcoane, D. Schwabe, M. Kieslich, E. HattingenDifferentiation between high and low grade tumours in paediatric patients by using apparent diffusion coefficients Eur J Paediatr Neurol, 17 (3) (2013), pp. 302-307
- L.G. Astrakas, D. Zurakowski, A.A. Tzika, M.K. Zarifi, D.C. Anthony, U. De Girolami, et al.Noninvasive magnetic resonance spectroscopic imaging biomarkers to predict the clinical grade of pediatric brain tumors Clin Cancer Res, 10 (24) (2004), pp. 8220-8228
- O. Gonen, Z.J. Wang, A.K. Viswanathan, P.T. Molloy, R.A. ZimmermanThree-dimensional multivoxel proton MR spectroscopy of the brain in children with neurofibromatosis type 1 AJNR Am J Neuroradiol, 20 (7) (1999), pp. 1333-1341
- Panigrahy, S. BlumlNeuroimaging of pediatric brain tumors: from basic to advanced magnetic resonance imaging (MRI) J Child Neurol, 24 (11) (2009), pp. 1343-1365