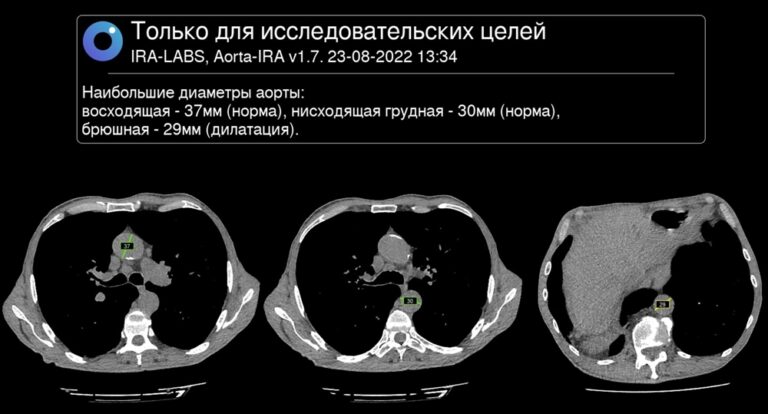
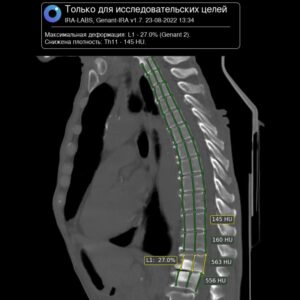
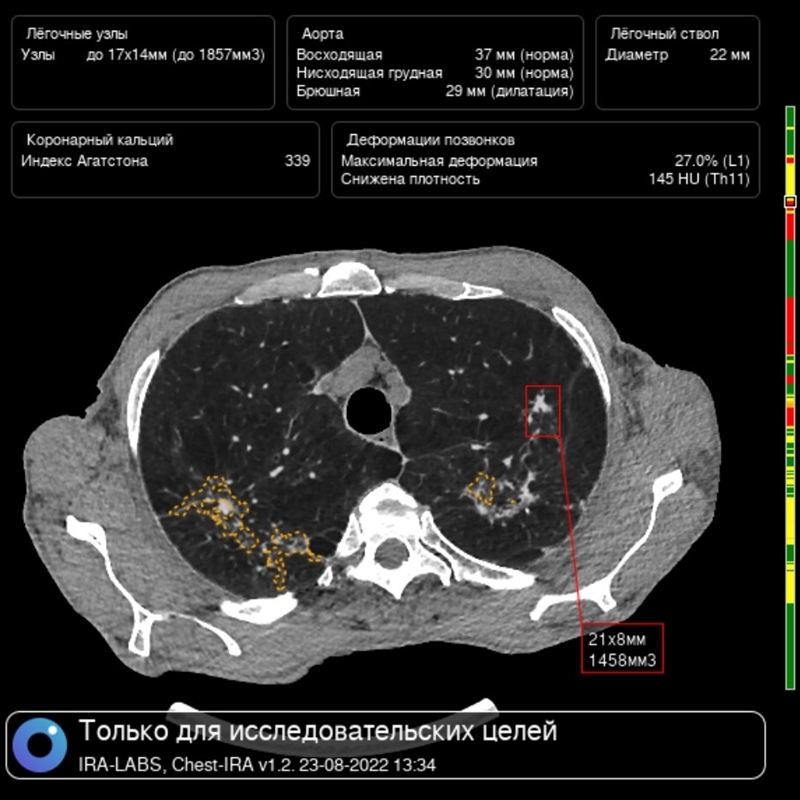
ИСКУСТВЕННЫЙ ИНТЕЛЕКТ КТ-СКРИНИНГА РАКА ЛЕГКОГО
1. Общее
Искусственный интеллект (ИИ) может повысить эффективность скрининга рака легких. В настоящее время в США существует одна основная система отчетности для интерпретации ежегодных скрининговых КТ: Lung-RADS [1]. Использование этой системы классификации является обязательным для скрининговых центров в США для получения возмещения.
2. Производительность алгоритмов
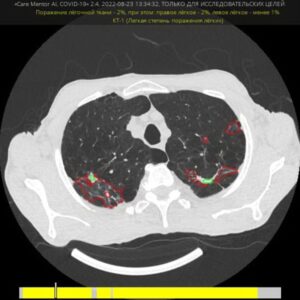
В анализе медицинских изображений сверточную нейронную сеть являются предпочтительной методологией, и их производительность достигает или даже превосходит человеческие возможности при выполнении все большего числа задач [5].
3. Качество сканирования
В последние годы также были внедрены методы глубокого обучения для оптимизации дозы облучения и времени реконструкции [6]. Было опубликовано множество статей об алгоритмах искусственного интеллекта для обнаружения узелков в легких [7, 8]. Среди научных публикаций сложно сравнивать производительность алгоритмов, поскольку в каждом исследовании могут использоваться разные наборы данных, эталонные стандарты и метрики оценки. Вот почему задачи важны в области искусственного интеллекта: задачи — это открытые для публики соревнования по разработке алгоритма для конкретной задачи.
4. Обнаружение узелков
Первой веб-платформой для сравнения алгоритмов обнаружения узлов на компьютерной томографии при скрининге рака легких было исследование Automated Nodule Detection 2009 (ANODE09) [9].
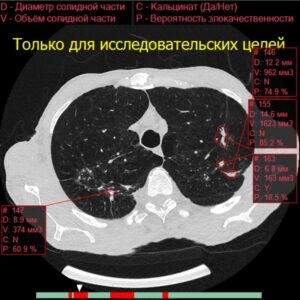
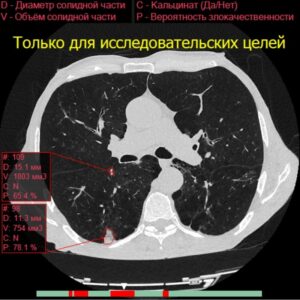
5. Классификация и измерение узелков
После обнаружения узлов рекомендации разделяют их на группы риска злокачественного новообразования на основе двух основных критериев: размера и типа [1-4].
6. Прогноз злокачественных новообразований
Больший размер узлов и их рост, безусловно, являются лучшими предикторами злокачественного новообразования при КТ [10, 12].
7. Прогноз злокачественных новообразований
В конечном счете, цель КТ-скрининга рака легких — предсказать, есть ли у участника рак легких. Наиболее известной статистической моделью риска для оценки риска злокачественного образования узлов является модель Брока (также известная как модель PanCan) [12] В 2019 году Ардила и др. [13] опубликовали исследование, в котором говорится о более высокой производительности их сети глубокого обучения по сравнению с шестью рентгенологами при оценке риска рака легких по результатам одного КТ (абсолютное снижение ложноположительных результатов = 11%; абсолютное снижение ложноотрицательных результатов =5%).
8. Как можно использовать искусственный интеллект?
Хотя утверждения требуют более тщательной проверки, в предыдущем разделе указано, что современные алгоритмы искусственного интеллекта для обнаружения рака легких при КТ, возможно, достигли уровня рентгенолога. Однако в этих исследованиях сравнивались только индивидуальные характеристики и не рассматривалось сотрудничество между человеком и машиной. Определенные задачи, которые считаются более сложными для радиолога, могут быть проще для алгоритма, и наоборот.
9. Как можно использовать искусственный интеллект?
В парадигме параллельного чтения рентгенолог имеет немедленный доступ к результатам системы искусственного интеллекта и использует их при интерпретации изображения. Наконец, система искусственного интеллекта первого считывания будет позволять рентгенологу оценивать только узлы, уже обнаруженные искусственным интеллектом.
Последняя стратегия ограничивает интерпретацию радиолога областями интереса и, следовательно, обеспечивает кратчайшее время считывания, но узелки, пропущенные системой искусственного интеллекта, останутся незамеченными.
Для первой парадигмы чтения решающее значение имеет высокая чувствительность ИИ. Обратите внимание, что коммерческие системы обнаружения узелков на сегодняшний день одобрены для использования только в качестве одновременного или второго считывателя.
10. Какие исследования необходимы дальше?
Во многих исследованиях ИИ описываются новые архитектуры для обнаружения узлов в легких, где эталонный стандарт установлен консенсусом радиологов. Однако конечная цель состоит не в том, чтобы найти все узелки, а в том, чтобы обнаружить все виды рака легких. Поэтому будущие исследования должны быть сосредоточены на эталонном стандарте, в котором измеряется выявление рака, определяемое гистопатологическими доказательствами или последующими визуализационными исследованиями в течение как минимум 2 лет (в зависимости от морфологии), чтобы продемонстрировать стабильность поражений.
11. Выводы
Будущие исследования должны быть сосредоточены на крупномасштабной проверке новых алгоритмов, основанных на глубоком обучении, и должны учитывать новые парадигмы чтения. Если обученных читателей с помощью алгоритмов искусственного интеллекта можно будет использовать для сортировки обычных сканирований, это может существенно повлиять на экономическую эффективность скрининга.
Этот эффект был бы больше, если бы полностью автономным алгоритмам было разрешено выполнять сортировку путем выбора потенциально аномальных КТ-сканирований для отправки на проверку рентгенологам.
Однако, чтобы гарантировать, что их использование безопасно и ответственно, требования к реализации автономных алгоритмов должны быть более обширными, чем когда в цикле все еще присутствует обученный читатель.
12. Автор
Дата публикации 21.02.2024г.
Данная статья не написана искуственным интелектом (AI-free). Допускается использование содержания статьи и распространение её полностью и частично при наличии гиперссылки на источник (данную интернет-страницу).
13. Исследования
14. Литература
- American College of Radiology. Lung CT Screening Reporting & Data System v1.1. 2019.
- Callister ME, Baldwin DR, Akram AR, et al. British Thoracic Society guidelines for the investigation and management of pulmonary nodules. Thorax 2015;70 Suppl 2:ii1-54. 10.1136/thoraxjnl-2015-207168
- Wood DE, Kazerooni EA, Baum SL, et al. Lung Cancer Screening, Version 3.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2018;16:412-41. 10.6004/jnccn.2018.0020
- Oudkerk M, Devaraj A, Vliegenthart R, et al. European position statement on lung cancer screening. Lancet Oncol 2017;18:e754-66. 10.1016/S1470-2045(17)30861-6
- Litjens G, Kooi T, Bejnordi BE, et al. A survey on deep learning in medical image analysis. Med Image Anal 2017;42:60-88. 10.1016/j.media.2017.07.005
- Willemink MJ, Noël PB. The evolution of image reconstruction for CT-from filtered back projection to artificial intelligence. Eur Radiol 2019;29:2185-95. 10.1007/s00330-018-5810-7
- Liu B, Chi W, Li X, et al. Evolving the pulmonary nodules diagnosis from classical approaches to deep learning-aided decision support: three decades’ development course and future prospect. J Cancer Res Clin Oncol 2020;146:153-85. 10.1007/s00432-019-03098-5
- Li D, Mikela Vilmun B, Frederik Carlsen J, et al. The Performance of Deep Learning Algorithms on Automatic Pulmonary Nodule Detection and Classification Tested on Different Datasets That Are Not Derived from LIDC-IDRI: A Systematic Review. Diagnostics (Basel) 2019;9:207. 10.3390/diagnostics9040207
- van Ginneken B, Armato SG, 3rd, de Hoop B, et al. Comparing and combining algorithms for computer-aided detection of pulmonary nodules in computed tomography scans: The ANODE09 study. Med Image Anal 2010;14:707-22. 10.1016/j.media.2010.05.005
- van Riel SJ, Ciompi F, Jacobs C, et al. Malignancy risk estimation of screen-detected nodules at baseline CT: comparison of the PanCan model, Lung-RADS and NCCN guidelines. Eur Radiol 2017;27:4019-29. 10.1007/s00330-017-4767-2
- Winkler Wille MM, van Riel SJ, Saghir Z, et al. Predictive Accuracy of the PanCan Lung Cancer Risk Prediction Model -External Validation based on CT from the Danish Lung Cancer Screening Trial. Eur Radiol 2015;25:3093-9. 10.1007/s00330-015-3689-0
- McWilliams A, Tammemagi MC, Mayo JR, et al. Probability of cancer in pulmonary nodules detected on first screening CT. N Engl J Med 2013;369:910-9. 10.1056/NEJMoa1214726
- Ardila D, Kiraly AP, Bharadwaj S, et al. End-to-end lung cancer screening with three-dimensional deep learning on low-dose chest computed tomography. Nat Med 2019;25:954-61. 10.1038/s41591-019-0447-x